| 本網頁資料僅供參考,如有疑問或錯誤請仍依廠商資料為主。 | |||||
| 醫令碼 | 20757 | 健保碼 | BC27309100 | ||
| 商品名 | JADENU 360MG | 藥品許可證 | 衛部藥輸字第027309號 | ||
| 中文名 | 解鐵定膜衣錠 | 健保局藥理類別 | 920000 未分類治療藥物 | ||
| 學名 | Deferasirox | 外觀描述 |
|
||
| 類別 | PHR | 劑量 | TAB | ||
| 抗生素 | 管制藥 | ||||
| 仿單 | JADENU 360MG |
||||
| 用藥指導單張 |  |
||||
| ATC7藥理類別 | V03AC03 deferasirox | ||||
| 孕婦用藥分級 | B 級: 在對照的動物生殖研究試驗中未顯示該藥物有胚胎毒性,但尚無完整的人體懷孕婦女研究試驗資料;或者在動物生殖對照研究試驗中發現該藥物有不良反應(大於降低生育力之反應),但在對照的人體懷孕婦女研究試驗中,未顯示該藥物有胚胎毒性。 |
||||
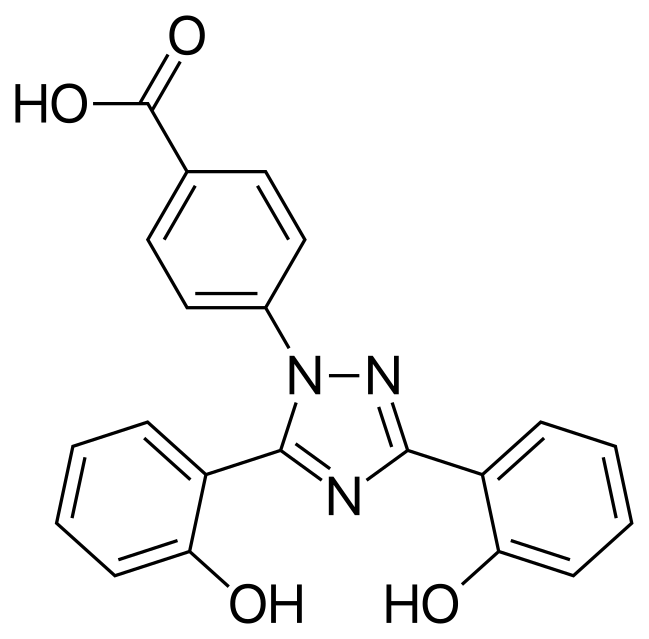
| 結構式 | |
|
Deferasirox |
|
| UpToDate | UpToDate 連結 |
| 藥理作用 | |
| Deferasirox 是一種具口服活性且對三價鐵有高度選擇性的螯合劑。它是一個三叉的配位基 (ligand) 可以 2:1 的比例結合有高親和性的鐵離子。Deferasirox 促進鐵的排出,主要排出於糞便中。Deferasirox 對鋅和銅的親和性低,並不會造成這些金屬的血清濃度持續低迷。 | |
| 適應症 | |
|
1. 治療因輸血而導致慢性鐵質沈著症(輸血性血鐵質沉積)的成年人及2歲以上兒童患者。 2. 治療10歲以上非輸血依賴型海洋性貧血患者之慢性鐵質沉著症。 |
|
| 用法用量 | |
|
服藥方法 Jadenu 膜衣錠應配水整顆吞服。無法吞服的病患,可將 Jadenu 磨碎,並加入軟質食物,例如:優格或蘋果泥中一併服用。磨碎後的 Jadenu 應立刻使用完畢。 Jadenu應每天服用一次,最好能在固定時間服用,可空腹或與輕食併服。起始劑量 建議起始劑量為每日 14 mg/kg。 每月輸血量大於 14 mL/kg 濃縮紅血球 (packed RBC) 的患者,目標在於降低鐵質 沈積的起始劑量為每日 21 mg/kg。 每月輸血量少於 7 mL/kg 濃縮紅血球 (packed RBC) 的患者,目標在於維持體內 鐵濃度的起始劑量為每日 7 mg/kg。 對於接受 deferoxamine 治療而控制良好的患者而言,可考慮以 deferoxamine 劑 量的三分之一作為 Jadenu 的起始劑量 ( 例如:每星期五天、每日接受 40 mg/kg deferoxamine 劑量(或等量)的患者,改用 Jadenu 後可以每日 14 mg/kg 為其起 始劑量 ),請見仿單中表 1 及表 3。 劑量調整 建議每個月監測血清儲鐵蛋白 (serum ferritin),必要時可依據血清儲鐵蛋白 (serum ferritin) 變化趨勢,每 3 到 6 個月調整 Jadenu 劑量。劑量可逐步以 3.5~7 mg/kg 調整,並依據每一位患者的反應及治療目標 ( 維持或減輕鐵負荷 ) 來調 整。患者在 21 mg/kg 劑量治療下未有獲得良好控制時 ( 例如血清儲鐵蛋白 (serum ferritin) 持續高於 2500 µg/L,且未隨時間顯示有降低的趨勢 ),可考慮使用最高達 28 mg/kg 的劑量。不建議使用超過 28 mg/kg 的劑量,因為只有少數使用超過 此劑量的經驗。 |
|
| 藥動力學 | |
|
吸收 Deferasirox ( 可溶錠劑型 ) 在口服後,達到最高血中濃度的時間 (tmax) 大約為 1.5 至 4 小時。相較於靜脈投與劑量,Deferasirox ( 可溶錠 ) 的絕對生體可用率 (AUC) 約為 70%。膜衣錠的絕對生體可用率仍未被確定。Jadenu 膜衣錠的生體可用率比 Exjade 可溶錠高 36%。食物交互作用試驗中,比較健康受試者在禁食、低脂飲食 ( 脂肪提供的卡路里小於總量的 10%) 與高脂飲食 ( 脂肪提供的卡路里大於總量的 50%) 的情況下,膜衣錠的吸收情形,結果顯示低脂飲食會使 AUC 及 Cmax 有些微降低 ( 分別降低 11% 及 16%)。而高脂飲食會讓 AUC 及 Cmax 上升 ( 分別上升 18% 及 29%)。劑型改變與高脂飲食所導致的 Cmax 上升可能具有加成性,因此建議空腹或在輕食後服用 Jadenu。 分布 Deferasirox 會與血清蛋白質高度結合 (99%),幾乎完全是血清白蛋白;且在成年人中分布體積小,將近 14 升。 生體轉化 Deferasirox 主要經尿苷酸化作用 (glucuronidation) 代謝,接著經由膽汁排出。在小腸中可能發生尿苷酸鹽的去結合作用,之後進行再吸收 ( 腸肝再循環 )。 Deferasirox 主要經由 UGT1A1 進行尿苷酸化作用 (glucuronidation),少部分經由 UGT1A3。在人體中 deferasirox 較少經 CYP450- 催化 ( 氧化性 ) 代謝 ( 約 8%)。於體外試驗中觀察到氫氧基尿素 (hydroxyurea) 對 deferasirox 代謝沒有抑制作用。Deferasirox 會經過腸肝再循環。在一項健康自願者試驗中,使用單一劑量 deferasirox 後再投予 cholestyramine 會使 deferasirox 暴露量 (AUC) 減少 45%。 排除 Deferasirox 與其代謝物主要經由糞便排除 ( 劑量的 84%)。Deferasirox 與其代謝物由腎排除的量很少 ( 劑量的 8%)。平均排除半衰期範圍為 8~16 小時。 |
|
| 副作用 | |
| 胃腸道不適(主要為噁心、嘔吐、腹瀉、或腹痛),及約7%患者有皮疹。這些反應是與劑量相關,大部份是輕度至中度,一般是短暫的,即使繼續治療也會消失。 | |
| 禁忌 | |
|
1. 肌胺酸酐清除率< 40 mL/min 或血清肌胺酸酐大於其年齡應有正常上限的2 倍。 2. 高危險群骨髓增生不良症候群患者,以及因疾病快速惡化而預期無法自螯合劑療法獲益的其他血液學和非血液學惡性腫瘤患者。 3. 對於有效成分或任一賦形劑過敏者。 |
|
| 給付規定 | |
|
4.3.1.Deferasirox(如Exjade)(96/7/1、104/12/1、108/7/1): |
|
| 注意事項 | |
|
腎衰竭 1. Jadenu 會造成急性腎衰竭與死亡,特別是倂有既有疾病及血液疾病處於 惡化期的患者。 2. 開始治療前應重複兩次測量血清肌胺酸酐濃度及測定肌胺酸酐清除率,之後應每個月監測腎功能。對於基期腎功能不全或具有增加急性腎衰竭風險因子的患者,開始治療的第一個月應每週監測血清肌胺酸酐濃度,之後至少每個月監測一次。依據血清肌胺酸酐濃度的增加,考慮降低劑量、中斷劑量、或停止用藥。 肝衰竭 1. Jadenu 會造成肝損害,包含肝衰竭及死亡。 2. 所有患者都應於開始治療前、開始治療的第一個月期間每兩週一次、以及之後至少每個月一次測量血清轉胺酶和膽紅素濃度。 3. 重度肝功能不全患者不應使用 Jadenu,中度肝功能不全患者應降低劑量。 胃腸出血 1. Jadenu會造成胃腸道出血,可能導致死亡,特別是在患有晚期血液惡性疾病和/或血小板低下的老年患者。 2.監測患者,若有疑似胃腸潰瘍或出血的徵象和症狀時,應停用 Jadenu。 |
|
| 過量處理 | |
| 投與高達 40 mg/kg 單一劑量可溶錠劑型 ( 相當於 28 mg/kg 的 Jadenu) 於正常受試者中,仍可良好地容忍。急性用藥過量的早期徵象是對消化的影響,例如腹痛、腹瀉、噁心和嘔吐。曾通報肝臟和腎臟疾病,包括肝臟酵素和肌酸酐增加,然治療中斷後,肝臟酵素和肌酸酐可恢復。錯誤使用單一劑量 90 mg/kg 曾導致范可尼氏症候群(Fanconi syndrome),其於治療後緩解。目前尚無 deferasirox 的特定解毒劑。在醫療適當的情況下,可採取處置用藥過量(例如催吐或洗胃)的標準程序以及對症治療。 | |
| 藥品保存方式 | |
| 儲存於室溫 25℃。 | |