| 本網頁資料僅供參考,如有疑問或錯誤請仍依廠商資料為主。 | |||||
| 醫令碼 | 23457 | 健保碼 | |||
| 商品名 | brilinta ★ 60mg(低劑量)(自費) | 藥品許可證 | 衛部藥輸字第027145號 | ||
| 中文名 | 百無凝膜衣錠 | 健保局藥理類別 | 201218 血小板凝集抑制劑 | ||
| 學名 | Ticagrelor | 外觀描述 |
|
||
| 類別 | PHR | 劑量 | TAB | ||
| 抗生素 | 管制藥 | ||||
| 仿單 | brilinta ★ 60mg(低劑量)(自費) |
||||
| 用藥指導單張 |  |
||||
| ATC7藥理類別 | B01AC24 ticagrelor | ||||
| 孕婦用藥分級 | C 級: 在對照的動物研究試驗中顯示該藥學物對胚胎有不良反應(致畸胎性或殺胚胎性或其他),但未進行人體懷孕婦女研究;或者尚無對照的人體懷孕婦女或動物研究試驗。只有在可能的利益大於潛在的危險,才可使用此藥物。 |
||||
| 結構式 | |
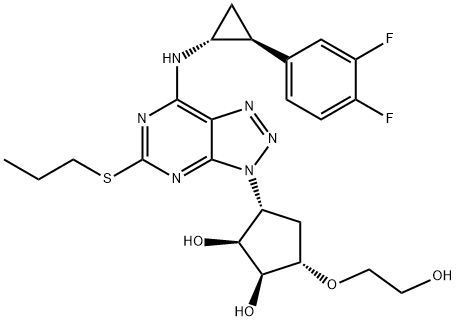 Ticagrelor (1S,2S,3R,5S)-3-[7-[(1R,2S)-2-(3,4-Difluorophenyl)cyclopropylamino]-5-(propylthio)- 3H-[1,2,3]triazolo[4,5-d]pyrimidin-3-yl]-5-(2-hydroxyethoxy)cyclopentane-1,2-diol |
|
| UpToDate | UpToDate 連結 |
| 藥理作用 | |
| Ticagrelor 及其主要代謝物與血小板P2Y12 ADP- 受體進行可逆地相互作用,以防止訊息傳導和血小板活化。Ticagrelor 及其活性代謝物大約等效。 | |
| 適應症 | |
|
1.急性冠心症或心肌梗塞病史 B rilinta與Aspirin併用,可減少急性冠心症(ACS)病人或有心肌梗塞(MI)病史合併有高風險發生動脈血栓事件病人之栓塞性心血管 (CV) 事件的發生率。對於ACS病人的治療,與Clopidogrel相比,Brilinta可以降低心血管死亡、心肌梗塞風險,於中風事件上,兩者並無差異;對於接受經皮冠狀動脈介入治療者,Brilinta亦可減少支架栓塞的風險。 2. 急性缺血性腦中風或暫時性腦缺血 (TIA) Brilinta與Aspirin併用,適用於降低急性缺血性腦中風 (NIHSS 分數 ≤5) 或高風險暫時性腦缺血 (TIA) 病人之中風風險。說明:開始治療前,宜考量個別病人中風之風險及出血風險,使Brilinta與Aspirin併用治療的預期效益大於潛在風險。 臨床試驗中,相較於Aspirin單獨療法,Brilinta與Aspirin併用治療中風之風險降低,而嚴重 (含致死) 出血風險升高。 |
|
| 用法用量 | |
|
Brilinta與Aspirin併用時,Aspirin每日維持劑量不可超過100 mg。 劑量 急性冠心症 Brilinta 的預載劑量(loading dose)為單劑 180 mg (兩顆 90 mg 錠劑),接著每次90 mg,每日兩次,建議治療持續 12 個月,除非臨床上有需要停藥 。使用Brilinta加上 Aspirin 每日維持劑量 75-100 mg。 心肌梗塞病史 Brilinta 60 mg每日兩次建議在有一年以上 MI 病史合併有高風險發生動脈血栓事件的病人,需要延長治療時使用。具高風險動脈血栓事件的 ACS 病人,使用 Brilinta 90 mg 或其他二磷酸腺苷 (ADP) 受體抑制劑療法初步一年治療之後,Brilinta 60 mg 每日兩次可作為接續療法而無須中斷。治療亦可在發生 MI 後2 年內、或停用先前 ADP 受體抑制劑治療後 1 年內開始。Brilinta作為延長治療超過 3 年的療效和安全性資料有限。 急性缺血性腦中風或暫時性腦缺血 (TIA) Brilinta與Aspirin併用治療:開始治療時,Brilinta的預載劑量為單次口服180 mg,後續則每日兩次、每次口服90 mg持續30天,療效在療程初期顯現;Aspirin的預載劑量為單次口服300至325 mg,後續則每日一次,每次口服75-100 mg。 給藥途徑 無法吞嚥錠劑之病人可將Brilinta膜衣錠壓碎後混入水中並喝下。該混合藥液亦可透過鼻胃管(CH8或更大)給藥。 |
|
| 藥動力學 | |
|
吸收 Ticagrelor 吸收的tmax 中位數為1.5 小時(範圍1.0-4.0)。從ticagrelor 形成主要循環代謝物AR-C124910XX(活性)的中位tmax 為 2.5小時(範圍1.5-5.0)。 Ticagrelor 的絕對生體可用率平均約36%(範圍30%-42%)。吃高脂飲食對ticagrelor 的Cmax 沒有影響,但會使AUC 增加21%,主要代謝物的Cmax 減低22%,AUC沒有變化。BRILINTA可與食物併服或空腹服用。 分佈 Ticagrelor 的穩定狀態分佈體積為88L。 Ticagrelor 及其活性代謝物與人類血漿蛋白廣泛結合(> 99%)。 代謝 CYP3A4 是負責ticagrelor 代謝及其主要活性代謝物形成的主要酵素。Ticagrelor及其主要活性代謝物是弱P- 醣蛋白受質和抑制劑。對活性代謝物的全身暴露量約為ticagrelor暴露量的30-40%。 排泄 Ticagrelor排除的主要途徑是肝代謝。當給予放射性標記ticagrelor,放射性的平均回收約84%(在糞便中58%,在尿中26%)。Ticagrelor 及其活性代謝物在尿中的回收都低於劑量的1%。Ticagrelor 的主要代謝物的主要排除途徑最有可能是膽汁 分泌。Ticagrelor 的平均半衰期(t1/2)約7小時,活性代謝物約9 小時。 |
|
| 副作用 | |
| 頭痛、頭暈、咳嗽、腹瀉、背痛、不尋常出血、呼吸困難。 | |
| 交互作用 | |
|
與強效CYP3A抑制劑併服 Ticagrelor會被CYP3A4/5代謝。避免與強效CYP3A抑制劑併用,例如atazanavir、clarithromycin、indinavir、itraconazole、ketoconazole、nefazodone、nelfinavir、ritonavir、saquinavir、telithromycin和voriconazole |
|
| 禁忌 | |
|
1. 顱內出血病史 有顱內出血病史(ICH)的病人禁用Brilinta,因為此族群復發ICH的風險高。 2. 活動性出血 有活動性病理性出血(例如消化性潰瘍或顱內出血)的病人禁用。 3. 過敏反應 Brilinta禁用於已知對ticagrelor或本品任何成分過敏(例如:血管性水腫)的病人。 4. 重度肝功能不全 有重度肝功能不全的病人禁止使用Brilinta。重度肝功能不全可能會增加ticagrelor的血清濃度。未在有重度肝功能不全的病人中進行研究。 |
|
| 注意事項 | |
|
出血風險 抑制血小板功能的藥物(包括Brilinta)會增加出血風險,包括嚴重、致命的出血。Brilinta不可使用於活動性病理性出血或顱內出血病史者。 急性缺血性腦中風或暫時性腦缺血 (TIA) 之病人 NIHSS 分數 >5之病人以及接受血栓溶解治療(thrombolysis)之病人被排除在THALES試驗之外,且不建議這類病人使用Brilinta。 可能的話,處理出血不要停止使用Brilinta。停止使用Brilinta可能增加隨後心血管事件的風險。 |
|
| 過量處理 | |
|
目前無已知治療可逆轉Brilinta 的效果,預計ticagrelor 不可經由透析排除。藥物過量的治療應遵循本地標準醫療作業。出血是藥物過量可預期的藥理效應。如果發生出血,應採取適當支持性措施。 藥物過量的其他症狀可能包括影響胃腸道(噁心、嘔吐、腹瀉)或心室停歇。須監視心電圖(ECG)。 |
|
| 藥品保存方式 | |
| 請儲存於30°C以下。 | |