|
|
|
|
| 本網頁資料僅供參考,如有疑問或錯誤請仍依廠商資料為主。 |
| 醫令碼 |
20560 |
健保碼 |
AC55939100 |
| 商品名 |
EXMEM F.C. 10MG |
藥品許可證 |
衛署藥製字第055939號 |
| 中文名 |
拾憶膜衣錠 |
健保局藥理類別 |
289200 其他中樞神經系統藥物 |
| 學名 |
Memantine |
外觀描述 |
|
| 類別 |
PHR |
劑量 |
TAB |
| 抗生素 |
|
管制藥 |
|
| 仿單 |
EXMEM F.C. 10MG
|
| 用藥指導單張 |
 |
| ATC7藥理類別 |
N06DX01 memantine |
| 孕婦用藥分級 |
B 級:
在對照的動物生殖研究試驗中未顯示該藥物有胚胎毒性,但尚無完整的人體懷孕婦女研究試驗資料;或者在動物生殖對照研究試驗中發現該藥物有不良反應(大於降低生育力之反應),但在對照的人體懷孕婦女研究試驗中,未顯示該藥物有胚胎毒性。 |
| 結構式 |
|
|
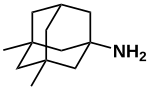
Memantine
1-amino-3,5-dimethyl-adamantane
|
| UpToDate |
UpToDate 連結
|
| 藥理作用 |
|
|
有更多的證據顯示:麩胺酸性神經傳導(glutamatergic neurotransmission)的官能障礙,尤其在NMDA 受器體過度刺激時,會促成神經退化性失智症的症狀表現及疾病進展。Memantine 為一電位調控型、中度親和力、非競爭性之NMDA 受器拮抗劑,可阻斷因麩胺酸(glutamate)強度升高作用造成之神經障礙。
|
| 適應症 |
|
|
治療中重度及重度之阿茲海默症。
|
| 用法用量 |
|
成人:
每日最大劑量為 20 毫克,為了降低副作用的風險,前三個星期應以 每個禮拜 5 毫克往上增加以達維持劑量,如下:第一個星期每天 5 毫克(早上半顆),第二個星期每天 10毫克(一天兩次,每次半顆),第三個星期建議每天 15 毫克(早上一顆,下午半顆),第四個星期起,維持劑量建議為每天20 毫克(一天兩次,一次一顆)。
老年人:
65歲以上老人之建議劑量為每天20毫克(一天兩次,一次一顆),如上所述。
本品可與食物併服或單獨服用。
|
| 藥動力學 |
|
吸收:
Memantine 的生體可用率近乎100%,tmax 為3 至8 小時,食物不會
影響memantine 的吸收。
線性:從一健康受試者的研究中,已證明10~40 毫克的劑量範圍內為線性藥物動力學。
分佈:
每日memantine 20 毫克達成之穩定狀態血中濃度範圍為70~150ng/ml
(0.5~1μmol),個體差異很大。當每日劑量為5~30 毫克時,平均CSF/serum=0.52,擬似分佈體積約為10 l/kg,約45%的memantine 和血漿蛋白結合。
生物轉換:
於人體中,80%之memantine 相關物質為原型藥物,主要代謝物為N-3,5-dimethyl-gludantan,為4-和6-hydroxy-memantine 之異構混合物及 1-nitroso-3,5-dimethyl-adamantane。這些代謝物無拮抗NMDA 之活性,體外試驗亦無偵測到cytochrome P450 催化此代謝反應。一研究指出,口服投與14C-memantine,20 天之內可回收84%的藥量,99%以上則由腎臟排除。
排除:
Memantine 以單指數方式排除,其最終半衰期(terminal half-life)為
60~100 小時。腎功能正常之受試者,全身清除率(Cl tot)為170ml/min/1.73m2,部分之總腎臟清除率則來自於腎小管分泌作用。腎功能亦包括腎小管再吸收作用,可能經由陽離子運輸蛋白傳達。於鹼性尿液狀態下,memantine 之腎排除率會因pH 值升高(7~9)而降低(參考特別警語及注意事項)。尿液鹼化可能由飲食習慣徹底改變,如肉食者改為素食者,或大量飲用鹼性胃液所導致。
|
| 副作用 |
|
|
幻覺、困惑、暈眩、 頭痛、疲倦。
|
| 交互作用 |
|
由於memantine 的藥理活性和作用機轉,可能發生下列交互作用;
˙併用NMDA-antagonist 如memantine,會增加L-dopa, dopaminergic
agonists, 和anticholinergics 的作用,而barbiturates 和neuroleptics的作用則被降低。Memantine 和antispasmodic agents, dantrolene 或baclofen 併用,會改變其作用,因此需要調整劑量。
˙由於藥毒性精神病症的風險,memantine 應避免和amantadine 併用,兩者的化合物在化學結構上和NMDA-antagonist 相關,ketamine 和dextromethorphan 亦如此(參考特別警語及注意事項)。已有一關於
memantine 和phenytoin 併用可能產生危險的案例報告。
˙其他藥物如cimetidine, ranitidine, procainamide, quinidine, quinine 和nicotine 使用和amantadine 相同的腎陽離子運輸系統(renal cationic transport system),亦可能和memantine 產生交互作用而導致血中濃度升高的潛在危險。
˙當memantine 或其他藥物和hydrochlorothiazide (HCT)併用時,可能會降低HCT 的排除。
Memantine 在體外試驗中顯示不會抑制CYP 1A2, 2A6, 2C9, 2D6, 2E1,
3A、含monooxygenase 之核黃素、epoxide hydrolase 和硫酸化的作用。
|
| 禁忌 |
|
|
對主成分或其它賦形劑會產生高度過敏反應者。
|
| 給付規定 |
|
1.3.3.失智症治療藥品
1.限用於依NINCDS-ADRDA或DSM或ICD標準診斷為阿滋海默氏症或帕金森氏症之失智症病患。
2.臨床診斷為「血管性失智症」,或有嚴重心臟傳導阻斷(heart block)之病患,不建議使用。(108/12/1)
3.初次使用者,需於病歷上記載以下資料:(106/10/1)
(1)CT、MRI或哈金斯氏量表(Hachinski lschemic Score)三項其中之任一結果報告。
(2)CBC, VDRL, BUN, Creatinine, GOT, GPT, T4, TSH檢驗。
(3)MMSE或CDR智能測驗報告。
4.依疾病別及嚴重度,另規定如下:
(1)阿滋海默氏症之失智症由神經科或精神科醫師處方使用。
Ⅰ.輕度至中度失智症:
限使用donepezil、rivastigmine及galantamine 口服製劑(90/10/1、92/1/1、95/6/1、100/3/1、102/8/1、106/10/1、108/5/1):
i.智能測驗結果為MMSE 10~26分或CDR 1級及2級之患者。
ii.使用前述三種藥品任一種後,三個月內,因副作用得換用本類另一種藥物,並於病歷上記載換藥理由。(93/4/1、102/8/1、106/10/1)
iii. 使用後每一年需重新評估,追蹤MMSE或CDR智能測驗,並於病歷記錄,如MMSE較前一次治療時減少2分(不含)以上或CDR退步1級,則應停用此類藥品。 (98/1/1、99/5/1、102/8/1、106/10/1、108/5/1)
iv.使用rivastigmine貼片劑(如Exelon Patch),每日限用一片,且不得併用同成分之口服藥品(100/3/1)。
Ⅱ.中重度失智症:
限使用memantine口服製劑(95/6/1、99/10/1、102/8/1、106/10/1、111/3/1)
i. 智能測驗結果為10≦MMSE≦14分或CDR 2級之患者。
ii. 曾使用過donepezil、 rivastigmine、galantamine其中任一種藥品之患者,使用後每一年需重新評估,追蹤MMSE或CDR智能測驗,MMSE較起步治療時減少2分(不含)以上或CDR退步1級,且MMSE或CDR智能測驗達標準(10≦MMSE≦14分或CDR 2級),得換用或併用memantine,惟Exiba、Evy、Manotin、Memary等4品項含memantine藥品不得與前述三種藥品併用。(106/10/1、111/3/1)
iii. 換用或併用memantine後每一年需重新評估,追蹤MMSE或CDR智能測驗,並於病歷記錄,如MMSE較前一次治療時減少2分(不含)以上或CDR退步1級,則應停用此類藥品。惟Ebixa Tablets及Evy Tablets等2種藥品,使用後每一年需重新評估,追蹤MMSE或CDR智能測驗,並於病歷記錄,如MMSE較起步治療時減少2分(不含)以上或CDR退步1級,則應停用此類藥品。(98/1/1、99/5/1、102/8/1、106/10/1、111/3/1)
Ⅲ.重度失智症:(99/10/1、102/8/1、108/5/1、111/3/1)限使用donepezil及memantine口服製劑或是兩者併用(惟Exiba、Evy、Manotin、Memary等4品項含memantine藥品不得併用) (102/8/1、108/5/1、111/3/1)
i.智能測驗結果為MMSE 5-9分且CDR 3級之患者。
ii.臥床或無行動能力者不得使用。
iii.曾使用過memantine,donepezil,rivastigmine, galantamine而不再適用者,不得使用。
iv.donepezil及memantine二者不能併用。
v.使用後每一年需重新評估,追蹤MMSE智能測驗,如MMSE較前一次治療時減少2分(不含)以上,則應停用此類藥品。惟Ebixa Tablets 及Evy Tablets等2種藥品,使用後每一年需重新評估,追蹤MMSE智能測驗,如MMSE較起步治療時減少2分(不含)以上,則應停用此類藥品。(99/10/1、102/8/1、108/5/1)
(2)帕金森氏症之失智症(99/5/1、100/3/1、102/8/1)
限神經科醫師診斷及處方使用於輕度至中度之失智症。
限使用rivastigmine口服製劑 (102/8/1)
Ⅰ.智能測驗結果為MMSE 10~26分或CDR 1級及2級之患者。
Ⅱ.失智症發生於帕金森氏症診斷至少一年以後。
Ⅲ.使用後每一年需重新評估,追蹤MMSE或CDR智能測驗,如MMSE較前一次治療時減少2分(不含)以上或CDR退步1級,則應停用此類藥品。(99/5/1、102/8/1)
備註: 起步治療定義:係指同組藥品第一次申請同意治療之評分
|
| 注意事項 |
|
|
中重度至重度阿茲海默症通常會使駕車能力和機械操作能力受損;此外,memantine 可能改變反應力,應提醒出院病人駕車或操作機械時需特別小心。
|
| 藥品保存方式 |
|
|
於30℃以下儲存。
|
|
|







































