| 結構式 |
|
|
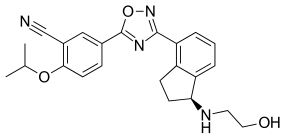
Ozanimod HCl
5-(3-{(1S)-1-[(2-hydroxyethyl)amino]-2,3-dihydro-1H-inden-4-yl}-1,2,4-oxadiazol-5-yl)-2-[(propan-2-yl)oxy]benzonitrile, monohydrochloride。
|
| UpToDate |
UpToDate 連結
|
| 藥理作用 |
|
|
Ozanimod 是鞘胺醇 1-磷酸鹽 (S1P) 受體調節劑,可與 S1P 受體 1 和 5 形成高親合力結合。Ozanimod 可阻斷淋巴球自淋巴結移出,使周邊血液中的淋巴球數量減少。ozanimod 對於多發性硬化症的療效機轉未知,但可能與移行到中樞神經系統的淋巴球數量減少有關。
|
| 適應症 |
|
|
適用於成人復發緩解型多發性硬化症的治療。
|
| 用法用量 |
|
維持劑量
在起始劑量調整後 (參閱起始治療),自第 8 天開始,ZEPOSIA 的建議維持劑量為每日一次口服 0.92 毫克。
ZEPOSIA 膠囊必須完整吞服,可隨餐或空腹服用。
|
| 藥動力學 |
|
吸收
Ozanimod 達到最高濃度的時間 Tmax 約為 6-8 小時。
食物作用
ZEPOSIA 搭配高脂高熱量食物服用後,ozanimod 的 Cmax 及 AUC 並未觀察到具臨床意義的差異。
分佈
Ozanimod 的擬似分佈體積 (Vz/F) 平均值 (CV%) 為 5590 L (27%)。Ozanimod、CC112273 及 CC1084037 的人類血漿蛋白質結合率,分別為 98.2%、99.8%、99.3%。
排除
Ozanimod 在血漿中的半衰期 (t1/2) 平均值 (CV%) 約為 21 小時 (15%)。在復發型多發性硬化症病人體內,CC112273 及其直接轉換代謝產物 CC1084037 的有效半衰期 (t1/2) 平均值 (CV%) 約為 11 天 (104%)。Ozanimod 的擬似口服清除率平均值 (CV%) 約為 192 L/h (37%)。
代謝
Ozanimod 經由多種酵素代謝為血液循環主要活性代謝產物 (如 CC112273 和 CC1084037) 以及次要活性代謝產物 (如 RP101988、RP101075 和 RP112509),對 S1P1 及 S1P5 有相同的活性及選擇性。Ozanimod 經 ALDH/ADH 代謝為羧酸鹽代謝物 RP101988,經 CYP3A4 作用形成 RP101075。而後 RP101075 可經由 NAT-2 作用形成 RP101442,或經由單胺氧化酶 B 作用形成 CC112273。CC112273 再由 CYP2C8 代謝形成 RP112509 或還原為 CC1084037。CC1084037 由 AKR 1C1/1C2 及/或 3β- 與 11β-HSD 代謝形成 CC112273。CC112273 與 CC1084037 之間的相互轉換有利於 CC112273 形成。在人體內,約 94% 的血液循環總活性藥物暴露量來自 ozanimod (6%)、 CC112273 (73%) 及 CC1084037 (15%)。
排泄
口服單劑放射標記 ozanimod 0.92 毫克後,約有 26% 放射活性隨尿液排出,37% 由糞便排出,主要組成為非活性代謝物。
|
| 副作用 |
|
|
上呼吸道感染、血壓升高、緩脈心律不整、轉胺酶濃度升高、背痛。
|
| 交互作用 |
|
強效 CYP3A 及 P-醣蛋白 (P-gp) 抑制劑
與 itraconazole (P-gp 及強效 CYP3A 抑制劑) 併用時,ozanimod 及其主要活性代謝產物 CC112273 及 CC1084037 的藥物動力學,沒有具臨床意義的差異。
強效 CYP2C8 抑制劑
Ozanimod 併用 gemfibrozil (強效 CYP2C8 抑制劑) 時,活性代謝產物 CC112273 及 CC1084037 的暴露量 (AUC) 分別增加約 47% 及 69%。與 gemfibrozil 併用時,ozanimod 的 AUC 沒有具臨床意義的差異。
BCRP 抑制劑
Ozanimod 併用環孢靈 (BCRP 抑制劑) 不影響 ozanimod 暴露量,但次要活性代謝產物 RP101988 和 RP101075 (主要活性代謝產物 CC112273 的直接前驅物) 暴露量則增加一倍。Ozanimod 併用 BCRP 抑制劑,也可能增加 CC112273 及 CC1084037 的暴露量。
強效 CYP2C8 誘導劑
在穩定狀態每日一次 600 毫克 rifampin (強效 CYP3A 和 P-醣蛋白誘導劑,及中效 CYP2C8 誘導劑) 併用單劑 ZEPOSIA 0.92 毫克,造成 ozanimod、CC112273 和 CC1084037 暴露量 (AUC) 分別減少 24%、 60%、55%。對 CC112273 和 CC1084037 的影響,主要是經由 CYP2C8 的誘導。
|
| 禁忌 |
|
|
下列病人禁用 ZEPOSIA:
1. 最近 6 個月內曾發生心肌梗塞、不穩定型心絞痛、中風、暫時性腦缺血 (TIA)、需住院治療的代償不全心臟衰竭 或第 III/IV 級心臟衰竭。
2. 患有莫氏 (Mobitz) 第 II 型二級或三級房室 (AV) 傳導阻滯、竇房結病變症候群或竇房阻滯,除非病人已裝置心律調節器。
3. 患有嚴重且未治療的睡眠呼吸中止症。
4. 目前服用單胺氧化酶 (MAO) 抑制劑。
5. 已知免疫不全狀態,如免疫不全症候群、或有較高伺機性感染風險之病人。
6. 嚴重活動性感染、急性與慢性活動性感染,例如肝炎和肺結核。
|
| 給付規定 |
|
8.2.3.1.Interferon beta-la (如Rebif) 、teriflunomide 14mg (如Aubagio)、dimethyl fumarate(如Tecfidera)、peginterferon beta-1a (如Plegridy)、ozanimod(如Zeposia):(91/4/1、97/8/1、100/10/1、106/10/1、107/7/1、107/10/1、109/11/1、112/3/1)
1.限用於復發型多發性硬化症。
2.初次使用teriflunomide、dimethyl fumarate、peginterferon beta-1a及ozanimod時需經事前審查核准後使用(109/11/1、112/3/1)。
3.不適用於視神經脊髓炎(neuromyelitis optica,NMO),包括:(100/10/1)
(1)有視神經及脊髓發作。
(2)出現下列2種以上症狀:
i脊髓侵犯大於3節。
ii NMO-IgG or Aquaporin-4抗體陽性。
iii腦部磁振造影不符合多發性硬化症診斷標準。
4.Ozanimod每日限用1粒,若治療無效,第二線治療藥物不得使用fingolimod。(112/3/1)
5.Interferon beta-la、teriflunomide 14mg、dimethyl fumarate、peginterferon beta-1a、ozanimod僅得擇一使用。(112/3/1)
|
| 注意事項 |
|
開始 ozanimod 治療
所有病人在開始 ozanimod 治療之前,應進行心電圖檢查,確認有無既有的心臟異常。特定既有病症的病人,建議在第一劑藥物後接受監測。
肝臟損傷
接受 ZEPOSIA 治療的病人可能發生轉胺酶濃度升高。 在開始 ZEPOSIA 治療前,應取得最近 6 個月內的轉胺酶及膽紅素濃度。
血壓升高
由於接受 ZEPOSIA 治療的病人,即使在建議劑量下,皆可能與酪胺發生交互作用,因此食用酪胺含量極高(即 150毫克以上)的特定食物,可能會造成嚴重高血壓。病人服用 ZEPOSIA 時,由於對酪胺的敏感性增加,建議應避免食用酪胺含量高的食物。
施打疫苗
如果病人須施打減毒活疫苗,應在開始 ZEPOSIA 治療前至少 1 個月施打。應避免在 ZEPOSIA 治療期間和治療後 3 個月內,使用減毒活疫苗。
|
| 藥品保存方式 |
|
|
儲存於25°C以下。
|







































