| 結構式 |
|
|
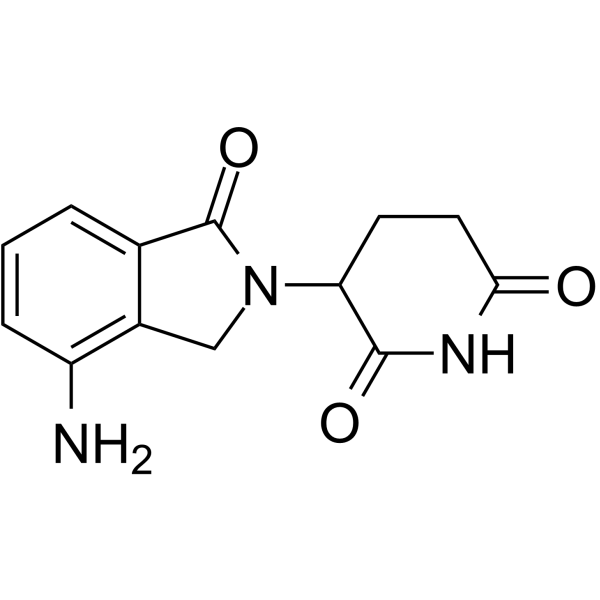
Lenalidomide
3-(4-amino-1-oxo-1,3-dihydro-2H-isoindol-2-yl) piperidine-2,6-dione
|
| UpToDate |
UpToDate 連結
|
| 藥理作用 |
|
Lenalidomide 的作用機制,仍有待進一步釐清,它具有抗腫瘤新生、免疫調節和抗血管新生的特質。Lenalidomide 能抑制周邊血液單核球分泌促進發炎的細胞激素,並增加抗發炎細胞激素的分泌。Lenalidomide 能抑制某些細胞的增殖,抑制強度(IC50s) 則不一,也未必能抑制所有的細胞株。在測試過的細胞株中,發現lenalidomide 能有效抑制Namalwa 細胞(一種人類B 細胞淋巴癌細胞株,少一個第5 號染色體)的生長,然而,對於KG-1 細胞(人類骨髓瘤細胞株,也少一個第5 號染色體)和其他沒有第5 號染色體缺失的細胞,生長抑制效果的效力有限。 Lenalidomide 能誘導細胞週期中止與凋亡,從而抑制由患者身上取得的多發性骨髓瘤細胞生長,也能抑制MM.1 S 細胞(一種人類多發性骨髓瘤細胞株)的生長。
體外實驗發現,lenalidomide 能抑制第2 型環氧合酶(COX-2) 活性,但並不抑制COX-1。
|
| 適應症 |
|
|
Revlimid與dexamethasone合併使用可治療先前已接受至少一種治療失敗之多發性骨髓瘤(multiple myeloma, MM)患者。
|
| 用法用量 |
|
建議的Revlimid 起始劑量為每日25 毫克,以水送服,在28 天用藥週期的第1 至21 天,每日服用1 顆25 毫克膠囊
[本藥請整顆吞服,不可打破、嚼碎或打開膠囊。]
|
| 藥動力學 |
|
吸收:
健康的自願受試者,口服投予lenalidomide 後,吸收十分迅速,在用藥後0.625 小時至1.5 小時之間,達成最大血漿濃度。
分佈:
體外實驗顯示,(14C)-lenalidomide 與血漿蛋白結合的比例約為30%。
代謝與排泄:
尚未有研究探討人體對lenalidomide 的代謝現象,在健康的自願受試者,約有2/3 的lenalidomide 透過尿液排出,而且結構並未改變,排出的速度高於腎絲球過濾率,因此藥物可能部分或完全經由主動分泌,排除半衰期約3 小時。
|
| 副作用 |
|
|
貧血、周邊水腫、便秘、腹瀉、抽筋。
|
| 交互作用 |
|
人類的體外代謝實驗與非臨床試驗均指出,REVLIMID(lenalidomide) 不經細胞色素P450 路徑代謝,也不會抑制或誘發此代謝路徑,這意味lenalidomide 在人體內不太可能導致P450 代謝的藥物交互作用,也不受此交互作用的影響。
併用多劑10 毫克lenalidomide,並不影響單劑R- 與S-warfarin 藥物動力學。
併用單劑25 毫克warfarin,對總lenalidomide 的藥物動力學並無影響。warfarin 用藥後,可觀察到PT 與INR 檢驗值的預期變化,變化幅度並未因為同時服用lenalidomide 而異。
digoxin 併用lenalidomide,digoxin 的AUC 並無顯著差異,然而Cmax 則增加14%。同時服用digoxin 的患者,建議在服用lenalidomide 期間,定期監測digoxin 的血漿濃度;此一措施符合標準臨床實務與判斷。
|
| 禁忌 |
|
|
若已確知患者對於REVLIMID (lenalidomide) 或其成份過敏,則絕對禁止使用。
|
| 給付規定 |
|
9.43 Lenalidomide(如Revlimid):(101/12/1、106/10/1、109/2/1、109/8/1、112/4/1)
1. 先前尚未接受過任何治療且不適用造血幹細胞移植的多發性骨髓瘤患者可使用lenalidomide併用dexamethasone作為第一線治療。開始治療時病患須同時符合下列(1)與(2)的條件:(109/2/1、109/8/1、112/4/1)
(1) 骨髓漿細胞(plasma cells)比例≧10%,或是經切片確認且有≧1顆的plasmacytoma。(112/4/1)
(2) 出現下列任一臨床症狀:(112/4/1)
Ⅰ.腎功能不全:serum creatinine>2.0mg/dL或estimated GFR (eGFR)<40 ml/min,且無其他原因可以解釋。
Ⅱ.高血鈣(corrected serum calcium>11.0 mg/dL或2.75 mmol/L)。
Ⅲ.貧血(Hemoglobin<10 gm/dL 且無其他原因可以解釋)。
Ⅵ.影像檢查確認之osteolytic bone lesion(s)。
Ⅴ.骨髓漿細胞(plasma cells)比例≧60%
Ⅵ.Serum free light-chain ratio≧100。
(3) 每4個療程重新申請時,須重新評估是否適合接受造血幹細胞移植。若經重新評估為已適合接受造血幹細胞移植者,即須停止Rd之治療。(112/4/1)
2. 與dexamethasone合併使用於先前已接受至少一種治療失敗之多發性骨髓瘤患者,且需同時符合下列(1)與(2)的條件:(101/12/1、112/4/1)
(1) 具有下列任一疾病惡化的指標: 病患開始治療前須在連續2次評估中均符合同一指標 (但若為plamacytoma 體積增加,或是新產生的bone lesion(s)或新plasmacytoma,則僅需1次評估):(112/4/1)
Ⅰ.若前一線治療中M component 最低值≧5 g/dL,血清M蛋白需增加≧1 g/dL;若前一線治療中M component最低值<5 g/dL,血清M蛋白需增加≧0.5g/dL。
Ⅱ.Urine M-protein需增加≧0.2 gm/24Hr,且需較前一線治療中的最低值增加≧25%。
Ⅲ.在non-secretary myeloma 病患,骨髓漿細胞 (plasma cells)之比例絕對值增加≧10%,且需較前一線治療中的最低值增加≧25%。
Ⅳ.新產生的bone lesion(s)或plasmacytoma;且須經病理切片證實。
Ⅴ.Plasmacytoma體積增加≧50%。
Ⅵ.周邊血液中漿細胞比例≧20%或漿細胞絕對值≧2000 cells/μL。
(2) 出現下列任一臨床症狀:(112/4/1)
Ⅰ.新產生的bone lesion(s)或plasmacytoma;且須經病理切片證實。
Ⅱ.Plasmacytoma 體積增加≧50%。
Ⅲ.高血鈣(corrected serum calcium>11.0 mg/dL 或 2.75 mmol/L)。
Ⅳ.貧血(Hemoglobin 下降幅度≧ 2gm/dL且無其他原因可以解釋)。
Ⅴ.腎功能惡化(eGFR需下降幅度≧25%),且無其他原因可以解釋。
Ⅵ.出現其他 end-organ dysfunctions。
3.須經事前審查核准後使用,每次申請事前審查之療程以4個療程為限,每4個療程須再次申請。
(1)每天限使用1粒。
(2)使用4個療程後,必須確定paraprotein(M-protein)未上升(即表示對藥物有反應或為穩定狀態)或對部分non-secretory type MM病人以骨髓檢查plasma cell為療效依據,方可繼續使用。
4. 每人終生至多給付24個療程為限(每療程為4週)。(106/10/1、109/2/1、109/8/1、112/4/1)
5. 112年3月31日以前已核定用藥之病人,得經事前審查核准後,使用至總療程上
限(即終生24個療程)或使用期間發生疾病惡化為止。(112/4/1)
|
| 注意事項 |
|
1.本藥僅能開立給患者,而且即使其他人有相似症狀,也絕不可分給他人服用。
2.本藥必須存放於兒童不可及之處,嚴禁提供給可能懷孕的婦女。
3.服用本藥期間,患者不得捐血。
|
| 警語 |
|
1. 可能導致人類先天畸型。
2. 具血液學毒性(嗜中性球缺少症與血小板缺乏症)。
3. 深部靜脈血栓與肺部血栓。
|
| 過量處理 |
|
|
臨床試驗期間,並未通報用藥過量案例。
|
| 藥品保存方式 |
|
|
儲存於25°C。
|







































