| 結構式 |
|
|
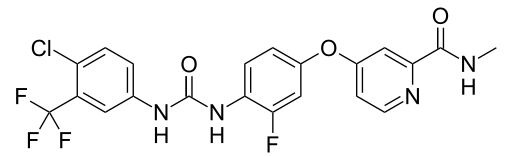
Regorafenib
4-[4-({[4-Chloro-3-(trifluoromethyl)phenyl]carbamoyl}amino)-3-fluorophenoxy]-N-methylpyridine-2-carboxamide hydrate
|
| UpToDate |
UpToDate 連結
|
| 藥理作用 |
|
|
Regorafenib為多種膜上激酶及細胞內激酶的小分子抑制劑,這些激酶參與了正常的細胞功能也涉及許多病理進程,包括腫瘤發生、腫瘤血管新生以及維持腫瘤微環境。於體外的生化或細胞分析中,regorafenib或其人體內主要活性代謝物M-2及M-5在達到臨床給藥的濃度下會抑制RET、VEGFR1、VEGFR2、VEGFR3、KIT、PDGFR-alpha、PDGFR-beta、FGFR1、FGFR2、TIE2、DDR2、Trk2A、Eph2A、RAF-1、BRAF、BRAFV600E、SAPK2、PTK5及Ab1。於體內模式中,利用大鼠腫瘤證實regorafenib具抑制血管新生的效果,而利用多個小鼠異種移植模式(包括一些人類結腸直腸癌),證實regorafenib可抑制腫瘤生長且具有抗腫瘤轉移效果。
|
| 適應症 |
|
(1) 大腸直腸癌 Regorafenib適用於治療先前曾接受下列療法的轉移性大腸直腸癌(mCRC)病人,療法包含 fluoropyrimidine‐, oxaliplatin‐ 和 irinotecan‐ 為基礎的化療,和抗血管內皮生長因子(anti‐VEGF) 等療法;若KRAS為原生型(wild type)則須接受過抗表皮生長因子受體(anti‐EGFR)療法。
(2) 腸胃道間質腫瘤適用於治療先前曾接受imatinib mesylate與sunitinib malate病人之局部晚期、無法切除或轉移性的腸胃道間質腫瘤病人。
(3) 肝細胞癌適用於治療曾接受sorafenib治療的肝細胞癌(HCC)病人。
|
| 用法用量 |
|
|
一個服藥週期為 28 天,建議劑量為每個週期的前 21 天,每日一次口服 160 mg STIVARGA (四顆 40 mg 藥錠)。持續接受治療直到病況惡化或發生無法接受的毒性。請於每日同一時間服用STIVARGA。請在食用一份所含熱量不到600卡路里且所含脂肪不到 30%的低脂餐點後,配水吞服整顆藥錠[藥物動力學特性(11)]。請勿為了彌補前一日的劑量,而在一日內服用兩份劑量的STIVARGA。
|
| 藥動力學 |
|
|
吸收
晚期實體腫瘤的病患單次使用癌瑞格160 mg後,regorafenib於4小時的中位數時間,達幾何平均血中最高濃度(Cmax) 2.5 μg/mL;血中濃度與時間曲線下面積(AUC)的幾何平均值為70.4 μg*h/mL。
分佈
24小時的給藥間隔,可觀察到regorafenib經腸肝循環,產生多次最高血中濃度。Regorafenib與人類血漿蛋白具有高結合度(99.5%)。
代謝
Regorafenib經由CYP3A4以及UGT1A9進行代謝。於穩定狀態下,人類血漿
中測量到的regorafenib主要循環代謝物為M-2 (N-oxide)和M-5 (N-oxide和
N-desmethyl),兩者與regorafenib有相似的體外藥理活性和穩定狀態濃度。M-2及M-5具高度的蛋白結合度(分別為99.8%和99.95%)。
排除
單次口服癌瑞格160 mg,regorafenib和其M-2代謝物的血中排除半衰期的幾
何平均值分別為28小時(14至58小時)及25小時(14至32小時)。M-5具較長的
平均排除半衰期(範圍),51小時(32至70小時)。
|
| 副作用 |
|
最常出現的不良反應(≥20%)為全身無力/疲倦、
HFSR、腹瀉、食慾降低/食物攝取減少、高血壓、粘膜炎、發音異常、感染、疼痛(無特別指定何種疼痛)、體重減輕、胃腸道與腹部疼痛、皮疹、發燒與噁心。
接受癌瑞格治療的患者中,最嚴重的藥物不良反應為肝中毒、出血及胃腸道穿孔。
|
| 禁忌 |
|
|
無。
|
| 給付規定 |
|
9.51.Regorafenib(如Stivarga):(104/9/1、105/8/1、107/12/1、108/6/1、110/6/1)
1.轉移性大腸直腸癌(mCRC):
(1)用於治療先前曾接受下列療法的轉移性大腸直腸癌(mCRC)患者,療法包括fluoropyrimidine、oxaliplatin、irinotecan為基礎的化療,和抗血管內皮生長因子(anti-VEGF)等療法;若K-ras為原生型(wild type),則需再加上接受過抗表皮生長因子受體(anti-EGFR)療法。(110/6/1)
(2)須經事前審查核准後使用,每次申請事前審查之療程以8週為限,再次申請必須提出客觀證據(如:影像學)證實無惡化,才可繼續使用。
2.胃腸道間質瘤(GIST)(105/8/1)
(1)先前曾接受imatinib與sunitinib治療的局部晚期、無法切除或轉移性的胃腸道間質瘤患者。
(2)需經事前審查核准後使用,每次申請之療程以3個月為限,送審時需檢送影像資料,每3個月評估一次。
3.肝細胞癌(HCC):(108/6/1)
(1)適用於曾接受sorafenib治療失敗後之轉移性或無法手術切除且不適合局部治療或局部治療失敗之Child-Pugh A class晚期肝細胞癌成人患者。
(2)需經事前審查核准後使用,初次申請之療程以3個月為限,之後每2個月評估一次。送審時需檢送影像資料,無疾病惡化方可繼續使用。
(3)每日至多處方4粒。
(4)Regorafenib與ramucirumab、nivolumab僅能擇一使用,不得互換。(110/5/1)
|
| 注意事項 |
|
1. 肝毒性
癌瑞格開始治療前須進行肝功能檢測(ALT、AST及膽紅素),且在治療的前2個月,至少每兩週要監測一次;接下來,每月至少須監測一次或依照臨床需要增加頻率。肝功能檢測數值升高的病患,須每週進行肝功能檢測,直到數值低於正常值上限/基期的三倍。
2. 出血
出現重度或危及生命的出血症狀的病患,請永久停用癌瑞格。接受warfarin的病患須更頻繁偵測其INR值。
3. 皮膚毒性
因皮膚毒性暫停使用癌瑞格後,降低劑量或永久停藥的決定取決於皮膚毒性的嚴重性及持續時間而定。進行支持性療法以緩解症狀。
|
| 警語 |
|
• 臨床試驗曾出現嚴重且可能致命的肝毒性現象。
• 在治療前及治療期間均需監測肝功能。
• 由肝功能檢測的數值上升程度及肝細胞壞死情形,可了解肝毒性的程度,再依據其嚴重程度及持續的時間來決定暫時停用癌瑞格,接下來應該降低藥量或終止使用癌瑞格。
|
| 過量處理 |
|
|
若疑似藥物過量,請停用癌瑞格、進行支持性療法,並持續觀察直到臨床跡象穩定。
|
| 藥品保存方式 |
|
儲存於30°C以下,運送時的允許溫度範圍為15至30°C (59至86°F)。
請將藥物儲存於原本的瓶子中,勿移除乾燥劑。首次開封後請鎖緊瓶蓋。
開瓶7週後,請將瓶中未使用的藥物丟棄。丟棄時請遵守當地規範。
|







































