| 結構式 |
|
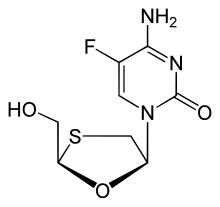
Emtricitabine:5-fluoro-1-(2R,5S)- [ 2-(hydroxymethyl)-1,3-oxathiolan-5-yl ] cytosine。
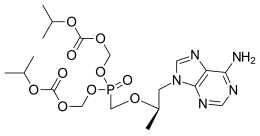
Tenofovir:9-([ R)-2[[bis[([ isopropoxycarbonyl)oxy]-methoxy]phosphinyl]methoxy]propyl]adenine fumarate(1:1)。
|
| UpToDate |
UpToDate 連結
|
| 藥理作用 |
|
Emtricitabine:FTC 為合成胞嘧啶核苷類似物,它由細胞酵素磷酸化形成 emtricitabine 5'-triphosphate(FTC-TP)。FTC-TP藉由與天然基質脫氧胞嘧啶5'-三磷酸鹽競爭並結合到初生病毒DNA中引起鏈終止,來抑制HIV-1 反轉錄酵素(RT)的活性。FTC-TP是哺乳動物DNA多聚酵素α、β、ε 和粒腺體DNA多聚酵素γ 的弱抑制劑。
Tenofovir Disoproxil Fumarate:TDF是腺苷單磷酸鹽的無環核苷磷酸鹽二酯類似物。TDF需要初始二酯水解,使其轉化為tenofovir,然後藉由細胞酵素磷酸化形成 tenofovir diphosphate(TFV-DP)。TFV-DP藉由與天然基質脫氧腺苷5'-三磷酸鹽競爭結合到DNA中,然後藉由DNA鏈終止作用來抑制HIV-1 RT的活性。TFV-DP是哺乳動物DNA多聚酵素α、β和粒腺體DNA多聚酵素γ的弱抑制劑。
|
| 適應症 |
|
1. 治療HIV-1感染
TRUVADA適用於與其他抗反轉錄病毒藥物合用治療成人及體重至少35 公斤的兒童病人HIV-1感染。
2. HIV-1暴露前預防性投藥(PrEP)
TRUVADA適用於在合併採取安全性行為下進行暴露前預防性投藥(PrEP),以降低具風險的成人及體重至少35公斤的青少年發生性傳染性HIV-1感染的風險。即將開始用藥前已確認為HIV-1陰性的病人才能以TRUVADA進行HIV-1暴露前預防性投藥。
|
| 用法用量 |
|
治療成人及體重至少35公斤的兒童HIV-1感染的建議劑量
TRUVADA於成人及體重至少35公斤的兒童病人的建議劑量為每日一次口服一錠,無須考慮是否須與食物併服。
HIV-1暴露前預防性投藥的建議劑量
對未感染HIV-1 的成人及體重至少35 公斤的青少年,建議劑量為每日一次口服一錠,可與/ 不與食物併服。
腎損傷病人的劑量調整:
治療HIV-1 感染
CrCl 30-49 mL/min:每 48小時一錠;
CrCl < 30 mL/min(包括需要進行血液透析的病人):不建議使用Truvada。
|
| 藥動力學 |
|
在口服給藥FTC後,FTC很快被吸收,尖峰血漿濃度出現在服藥後1-2 小時。在活體外,FTC與人類血漿蛋白的結合小於4%,且在0.02-200 μg/mL 濃度範圍內,此結合率不變。進行放射性標記的FTC治療後,約86%藉由尿液排出,約13%以代謝物排出。FTC的代謝物包括3'- 硫氧化物非對映異構體(3'-sulfoxide diastereomers)及它們的葡萄糖醛酸結合物(glucuronic acid conjugate)。Emtricitabine 經由腎小球過濾及主動腎小管分泌聯合排除。在單次口服FTC後,FTC之血漿半衰期約為10小時。
Tenofovir Disoproxil Fumarate:仿單表7 中概述了TDF 的藥物動力學特性。在口服給藥TDF 後,tenofovir 的尖峰血漿濃度出現在服藥後1.0±0.4 小時。在活體外(in vitro),tenofovir 與人類血漿蛋白的結合小於0.7%,且在0.01-25 μg/mL 濃度範圍內,此結合率不變。約70-80%的tenofovir 靜脈注射劑量在尿中以未改變的藥物排出。Tenofovir 經由腎小球過濾及主動腎小管分泌聯合排除。在單次口服TDF 後, tenofovir的最終排除半衰期約為17小時。
|
| 副作用 |
|
|
噁心、腹瀉、腹痛、血中amylase升高、紅疹。
|
| 禁忌 |
|
|
禁止對HIV-1 狀態不明或陽性的人使用TRUVADA進行HIV-1 暴露前預防性投藥。
|
| 警語 |
|
警告:對未確診的早期HIV-1感染病人使用TRUVADA進行HIV-1暴露前預防性投藥(PrEP),可能出現治療後B型肝炎急性惡化,並有引發抗藥性的風險。
已有報告顯示,感染B型肝炎病毒(HBV)的病人中斷使用TRUVADA會出現HBV重度急性惡化。應對中斷使用TRUVADA並感染HBV的病人至少進行數月的肝功能嚴密監測,同時在臨床上觀察並在實驗室中進行密切追蹤。如果合適,可開始進行抗 B型肝炎治療。只有對即將開始用藥前確認為HIV 陰性的病人才可使用TRUVADA 進行HIV-1 PrEP,且在用藥期間應定期(至少每3個月一次)進行確認。對未發現的急性HIV-1感染病人使用TRUVADA進行HIV-1 PrEP之後,曾檢出具抗藥性的HIV-1 突變病毒。如果出現急性HIV-1 感染的徵兆或症狀,切勿開始使用TRUVADA進行HIV-1 PrEP,除非確認感染狀態為陰性。
|
| 過量處理 |
|
|
出現藥物過量時,必須對病人進行毒性跡象監測,必要時施行標準支援治療。 Emtricitabine :在FTC定劑量給藥後1.5小時內開始持續3小時的血液透析治療,排除了約30%的FTC(血液流速400 mL /min,透析液流速600 mL /min)。暫未知FTC 是否可以透過腹膜透析排除。 Tenofovir Disoproxil Fumarate :Tenofovir 可經由提取係數大約為54%的血液透析有效地排除。在TDF單次300 mg口服給藥後,持續4小時的血液透析期間將排除約已服tenofovir劑量的10%。
|
| 藥品保存方式 |
|
|
請存放於25°C。
|







































