| 結構式 |
|
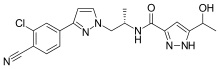
Darolutamide
N-{(2S)-1-[3-(3-chloro-4-cyanophenyl)-
1H-pyrazol-1-yl]propan-2-yl}-5-(1-hydroxyethyl)-1H-pyrazole-3-carboxamide
|
| UpToDate |
UpToDate 連結
|
| 藥理作用 |
|
Darolutamide是⼀種非固醇類的抗雄性素受體阻斷劑,具有帶彈性極性取代基之pyrazole結構,以⾼親和性直接與受體配機的結合位置結合以保持強勁阻斷雄性素受體(AR)抑制劑的作⽤。
Darolutamide以競爭⽅式抑制雄性素結合、雄性素受體的核易位以及AR媒介調節的轉錄。
Darolutamide於體內具有強勁的抗腫瘤效果(減少腫瘤細胞的增⽣),藉以在前列腺癌的異種移植模型中降低腫瘤體積。
|
| 適應症 |
|
1.治療非轉移性的去勢抗性前列腺癌(nmCRPC)的病人。
2.與docetaxel併用於治療轉移性的去勢敏感性前列腺癌(mCSPC,又稱 mHSPC)的病人。
|
| 用法用量 |
|
劑量療程
nmCRPC and mCSPC
建議劑量為每⽇服⽤兩次,每次服⽤600mgdarolutamide (兩錠300 mg膜衣錠) ,每⽇總劑量相當於1200 mg darolutamide。
建議與食物併服並吞服整顆藥錠。
應持續使⽤NUBEQA直到疾病惡化或出現不可接受的毒性 接受NUBEQA治療的病⼈還應同時接受黃體化激素釋放激素(LHRH)類似物或應進⾏雙側睪丸切除術。
|
| 藥動力學 |
|
吸收
⼝服600 mg (2錠300 mg)後,通常在服藥後約4⼩時達到最⾼⾎漿濃度4.79 mg/L (變異係數:30.9%)。根據穩定狀態的AUC(0-12)資料,兩種非鏡像異構物的比例((S,R)-darolutamide比(S,S)-darolutamide)從錠劑中的1:1變為⾎漿中約1:9的比例。在與食物併服給藥後,在每⽇兩次重複給藥2-5天後達到穩定狀態。
分佈
靜脈注射後darolutamide的擬分佈體積為119 L,顯⽰darolutamide廣泛分佈於全⾝的細胞內和細胞外液體空間。
Darolutamide與⼈類⾎漿蛋⽩中度(92%)結合,兩種非鏡像異構物之間並沒有任何差異。
darolutamide的主要代謝產物(keto-darolutamide)與⾎漿蛋⽩⾼度(99.8%)結合。
代謝/⽣物轉化
非鏡像異構物(S,R)-darolutamide和(S,S)-darolutamide能經由代謝物keto-darolutamide相互轉換,優先轉換為(S,S)-darolutamide。
清除/排除
Darolutamide和keto-darolutamide在病⼈⾎漿中的有效半衰期約為20⼩時。在包含 darolutamide的兩種鏡像異構物中,相較於(S,S)-darolutamide的有效半衰期為22⼩時,(S,R)-darolutamide的有效半衰期較短,為9⼩時。
靜脈注射後,darolutamide的清除率為 116 mL/min (CV:39.7%)。共有63.4%的藥物相關物質在尿液中排出(約7%為原型藥形式),32.4%在糞便中排泄,在服藥後7天內回收超過95%的劑量。
|
| 副作用 |
|
|
⽪疹、便祕、食慾不振、出⾎、體重增加與⾼⾎壓。
|
| 交互作用 |
|
CYP3A4和P-gp誘導劑
Darolutamide是CYP3A4和P-glycoprotein (P-gp)的受質。
重複服⽤rifampicin (600 mg) (⼀種強效CYP3A4和P-gp誘導劑),並在餐後服⽤單⼀劑量的darolutamide (600 mg),導致darolutamide的平均曝藥量降低72% [AUC(0-72)]且Cmax降低了52%。
除非沒有替代治療,否則不建議在使⽤NUBEQA治療期間使⽤強效CYP3A4誘導劑和P-gp誘導劑(例如carbamazepine、phenobarbital、聖約翰草)。應考慮選擇⼀種沒有具備或很弱誘導CYP3A4或Pgp可能性的替代併⽤藥物。
Docetaxel
投予darolutamide合併docetaxel治療不會對mCSPC病⼈的darolutamide藥物動⼒學造成臨床相關變化。
|
| 禁忌 |
|
|
NUBEQA使⽤上⽬前並無已知的禁忌症。
|
| 給付規定 |
|
9.94.Darolutamide(如Nubeqa):(110/11/1、112/9/1、113/5/1)
1.與docetaxel併用於治療高風險轉移性的去勢敏感性前列腺癌(mCSPC),總療程以24個月為上限。(113/5/1)
(1)須經事前審查核准後使用。
(2)每3個月需再次申請,再申請時若PSA值下降未超過治療前的50%以上,則需停藥。
(3)下降達最低值後之持續追蹤出現PSA較最低值上升50%以上且PSA≧2ng/mL,則需停藥,但影像學證據尚無疾病進展者,可以繼續使用。
(4)前述高風險需符合下列三項條件中至少兩項:
Ⅰ.葛里森分數(Gleason score)≧8。
Ⅱ.骨骼掃描出現四個(含)以上病灶且至少其中一處以上為非中軸骨及骨盆腔轉移。
Ⅲ.出現內臟轉移。
(5)與docetaxel併用,docetaxel限使用6個療程,且須符合下列所有條件:
Ⅰ.ECOG≦1。
Ⅱ.絕對嗜中性球計數≧1500/mm3。
Ⅲ.血小板計數≧100,000/mm3。
IV.GPT≦2倍之正常值上限。
V.Total bilirubin≦正常值上限。
VI.eGFR≧30mL/min/1.73m2
2.治療高風險非轉移性去勢抗性前列腺癌(high risk nmCRPC)的成年男性。
(1)須經事前審查核准後使用。
(2)初次申請時需檢附病理報告、使用雄性素去除療法紀錄,系列PSA和睪固酮數據,三個月內影像報告證明無遠端轉移。
(3)ECOG分數須≦1。
(4)PSA doubling time≦10個月,PSA倍增之時間,應依線性回歸模型計算,且其參數取得需基於下列原則:(112/9/1)
Ⅰ.至少三個連續PSA測量值,且各測量值皆≧0.2 ng/mL(最高的PSA值必須>1.0ng/ml)。
Ⅱ.應包含先前ADT治療期間的測量值,且最少一測量值為最近3個月內測得之PSA數值。
Ⅲ.第一個和最後一個PSA測量值間隔需≧8週,但≦12個月。
(5)每3個月需再次申請,申請之療程以3個月為限。再次申請時,有 PSA progression 者,需檢附影像學報告,若影像學報告證實轉移,則需停藥;無PSA progression 者,則每6個月需檢附影像學報告,若影像學報告證實轉移,則需停藥。(112/9 /1)
註:
PSA progression 定義為:PSA下降 達最低值(nadir)後,出現 PSA 值上升較 nadir≧25%,且PSA≧2 ng/mL,並於至少3週後,再次抽血 確認PSA值有上升趨勢。
3.不論病人處於轉移或非轉移的狀態下,終生僅能接受一種治療前列腺癌的新型荷爾蒙藥品(abiraterone、apalutamide、darolutamide和enzalutamide) 且僅能擇一給付,無效後不再給付其他新型荷爾蒙藥品,且除非出現嚴重不耐受反應導致必須永久停止治療的情況,不得互換。(112/9/1)
|
| 注意事項 |
|
|
在使⽤darolutamide治療期間使⽤強效CYP3A4和P-gp誘導劑可能會降低darolutamide的⾎中濃度,除非沒有替代治療,否則不建議使⽤。應考慮選擇⼀種較不可能誘導CYP3A4或P-gp的替代併⽤藥物。
|
| 過量處理 |
|
臨床上所研究的NUBEQA最⾼劑量為每⽇兩次900 mg,相當於每⽇總劑量為1800 mg,未在此劑量下觀察到劑量限制性毒性。
考慮到可飽和吸收(請參閱「藥物動⼒學特性」-「線性/非線性」)且沒有急性毒性的佐證,預期服⽤⾼於建議劑量的darolutamide並不會導致毒性。
如果服⽤劑量⾼於建議劑量,可以按照排定時程繼續進⾏下⼀劑的NUBEQA治療。
並無針對NUBEQA的特效解毒劑,⽽且尚未確定過量服⽤的症狀。
|
| 藥品保存方式 |
|
|
請儲存於30°C以下。
|







































